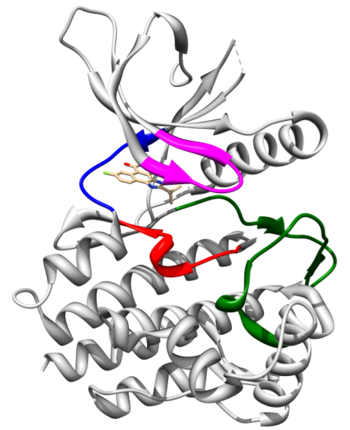
Kinaza JAK2
Kinaza JAK2 należy do rodziny niereceptorowych tyrozynowych kinaz białkowych JAK. Kinaza ta jest częścią ścieżek sygnalnych JAK2/STAT3/5 (Signal Transducer and Activator of Transcription) i uczestniczy w transdukcji sygnałów zewnątrzkomórkowych za pośrednictwem cytokin, czynników wzrostu i hormonów. Ma typową dla białek JAK czterodomenową budowę - od C-końca można wyróżnić następujące domeny: JH1, JH2, SH2 oraz FERM. Domena JH1 (aminokwasy 835 do 1132, PubMed NM 004972) kinazy JAK2 jest typową dla komórek eukariotycznych domeną katalityczną o aktywności kinazy tyrozynowej (PTK - Protein Tyrosine Kinase). Spełnia ona trzy kluczowe role: wiązanie i pozycjonowanie donora reszty fosforanowej (ATP, GTP) w kompleksie z dwuwartościowymi kationami (Mg2+, Mn2+), wiązanie i pozycjonowanie substratu peptydowego, a także transfer γ-fosforanu na aminokwas akceptorowy.
Pierwsza poznana struktura domeny kinazowej JAK2 to struktura krystalograficzna kompleksu tej domeny z inhibitorem CMP6 (Lucet et al. 2006). Ma ona typową dla kinaz dwupłatową budowę z płatem N-terminalnym (aminokwasy 840-931) oraz C-terminalnym (932-1132). Pierwszy płat jest złożony z pięciu antyrównoległych wstążek beta i jednej helisy alfa (αC). Drugi natomiast jest zbudowany z ośmiu helis alfa (αD-αK) i trzech par antyrównoległych wstążek beta (β7-β8, β6-β9, β10-β11). Centrum aktywne znajduje się w kieszeni pomiędzy płatami, które połączone są tzw. rejonem zawiasowym. Aminokwasy rejonu zawiasowego oraz pętli glicynowej biorą udział w wiązaniu cząsteczki ATP w centrum aktywnym. W wiązaniu substratów reakcji fosforylacji: cząsteczki ATP oraz białka uczestniczy również pętla aktywacyjna (aminokwasy 994-1024). Autofosforylacja tyrozyn 1007 oraz 1008 pętli aktywacyjnej działa jak molekularny przełącznik aktywności fosforylacyjnej kinazy JAK2. W wyniku autofosforylacji Tyr1007 oraz Tyr1008 dochodzi do otwarcia pętli aktywacyjnej i przesunięcia motywu DFG (aminokwasy 994-996), oddziałującego z jonami Mg2+, w pobliże centrum aktywnego. Autofosforylacja umożliwia ponadto wiązanie wielu białek regulatorowych, jak SOCS czy PTP. Pętla insercyjna (aminokwasy 1056-1078), charakterystyczna dla wszystkich domen kinazowych JAK, przypuszczalnie zaangażowana jest w regulację fosforylacji tych białek.
| fragment struktury | aminokwasy | struktura kompleksu domeny kinazowej JAK2 z inhibitorem CMP6 (kod PDB: 2B7A) |
|---|---|---|
| rejon zawiasowy | 929-935 (MEYLPYG) |
|
| pętla glicynowa | 856-861 (GKGNFG) | |
| pętla katalityczna (motyw PTK – Protein Tyrosine Kinase Active-site Signature) | 972-984 (YIHRDLATRNILV) | |
| pętla aktywacyjna (z motywami DFG (994-996) i APE (1022-1024) oraz autofosforylowaną parą tyrozyn Y1007/Y1008) | 994-1024 (DFGLTKVLPQDKEYY KVKEPGESPIFWYAPE) |
Znaczenie kliniczne kinazy JAK2
| Lp. | onkogen JAK2 | choroba hematologiczna | literatura |
|---|---|---|---|
| 1 | JAK2V617F | czerwienica prawdziwa (choroba Vasqueza) | Baxter et al. 2005 |
| nadpłytkowość samoistna i pierwotna mielofibroza | Lerine et al. 2005 | ||
| 2 | JAK2L611S | ostra białaczka limfoblastyczna | Funakoski-Tago et al. 2009 |
| 3 | JAK2K607N | ostra białaczka szpikowa | Lee et al. 2006 |
| 4 | JAK2D620E | nieklasyfikowalny syndrom mieloproliferacyjny | Schnittger et al. 2006 |
| 5 | JAK2ΔIREED | ostra białaczka limfoblastyczna komórek prekursorowych B | Malinge et al. 2007 |
| 6 | JAK2T875N | ostra białaczka megakarioblastyczna | Mercher et al. 2006 |
| 7 | TEL-JAK2 | ostra białaczka limfoblastyczna | Lacronique et al. 2000 |
| atypowa przewlekła białaczka szpikowa | Saharinen et al. 2003 | ||
| 8 | PCM1-JAK2 | chłoniaki T-komórkowe | Reiter et al. 2005, Adelaide et al. 2006 |
| atypowa przewlekła białaczka szpikowa | Bosquet et al. 2005 | ||
| ostra białaczka erytrocytarna | Murati et al. 2005 | ||
| 9 | BCR-JAK2 | atypowa ostra białaczka limfoidalna | Griesinger et al. 2005 |
| typowa przewlekła białaczka szpikowa | Griesinger et al. 2005 | ||
| ostra białaczka szpikowa | Cirmena et al. 2008 | ||
| 10 | RPN1-JAK2 | przewlekła idiopatyczna mielofibroza (zwłóknienie szpiku) | Mark et al. 2006 |
| 11 | SSBP2-JAK2 | ostra białaczka limfocytarna komórek prekursorowych B | Poitras et al. 2008 |
Mutacje somatyczne w genie jak2 podzielić można na dwie grupy:
- mutacje punktowe lub kilkuaminokwasowe delecje w wąskim obszarze domeny pseudokinazowej,
- translokacje chromosomalne prowadzące do powstania kinaz fuzyjnych.
Mutacje w domenie pseudokinazowej znoszą hamujący wpływ tej domeny na domenę katalityczną kinazy, w rezultacie powodując jej "nadaktywność". W wypadku translokacji chromosomalnych powstają tzw. tyrozynowe kinazy fuzyjne JAK2 (FTK - Fusion Tyrosine Kinase, Wilks 2008). Partnerem fuzyjnym C-końcowej części kinazy JAK2 są białka zdolne do oligomeryzacji. Umożliwia to autofosforylację kinazy JAK2 niezależną od aktywacji i dimeryzacji receptora transmembranowego.
Związki niskocząsteczkowe zdolne do hamowania aktywności katalitycznej kinazy JAK2 - inhibitory kinazy JAK2 są potencjalnymi lekami przeciwnowotworowymi. Obecnie są one intensywnie rozwijane głównie przez firmy farmaceutyczne na całym świecie. Istniejące już inhibitory są w większości współzawodnicze i blokują wiązanie cząsteczki ATP w centrum aktywnym domeny kinazowej JAK2. Należą do różnych klas azaheterocykli takich, jak np.: pirymidyny, pirydyny, benzimidazole, nikotynonitryle czy azaindole. Współczynniki IC50 lub stałe inhibicji KI wielu z tych związków osiąga niskie wartości nanomolarne lub też subnanomolarne. Niestety cechą tych inhibitorów kinazy JAK2 jest ograniczona selektywność działania ze względu na wysoki stopień konserowowania kieszeni wiążącej ATP. Obecnie wysiłki firm faramceutycznych zmierzają nie tyle do zwiększenia siły inhibitorów kinazy JAK2, ale poprawy ich selektywności działania. Obecnie około 10 inhibitorów kinazy JAK2 znajduje się różnych etapach testów klinicznych. Są one potencjalnymi lekami na choroby mieloproliferacyjne z onkogenami JAK2. Dwa z inhibitorów kinaz JAK zostały już zatwierdzone przez amerykańską Agencję ds Żywności i Leków (FDA):
- ruxolitinib (INCB018424) jako lek pod nazwą JAKAFI przeciwko zwłóknieniu szpiku,
- tofacitinib (tasocitinib, CP-690550) jako lek pod nazwą XELJANZ przeciwko reumatoidalnemu zapaleniu stawów.
| Lp. | inhibitor | choroba | firma / sponsor |
|---|---|---|---|
| 1 | LS104 | ostra białaczka limfoblastyczna, szpiczak mnogi | LymphoSign |
| 2 | AT9283 | szpiczak mnogi, ostra białaczka szpikowa, ostra białaczka limfoblastyczna, przewlekła białaczka szpikowa, zespoły mielodysplastyczne, pierwotna mielofibroza, nieokreślone guzy lite u dzieci, nieokreślone guzy lite u dorosłych, chłoniak, białaczka | Astex Therapeutics, NCIC Clinical Trials Group, Cancer Research UK, |
| 3 | atiprimod | rak w zaawansowanym stadium, rak neuroendokrynny, szpiczak mnogi | Callisto Pharmaceuticals, M.D. Anderson Cancer Center |
| 4 | AZD1480 | złośliwe guzy lite w stadium zaawansowanym, rak wątrobowokomórkowy w stadium zaawansowanym, guzy lite nieodpowiadające na standardowe terapie, rak wątroby nieodpowiadający na standardowe terapie z łagodną lub umiarkowaną funkcją wątroby, pierwotna i wtórna mielofibroza | AstraZeneca |
| 5 | CEP701 (lestaurtinib) |
pierwotna i wtórna mielofibroza, czerwienicz prawdziwa, nadpłytkowość samoistna, neuroblastoma, białaczka, ostra białaczka limfoblastyczna, ostra białaczka szpikowa, ciężka łuszczyca, rak prostaty, szpiczak mnogi w stadium zaawansowanym | Cephalon, Myeloproliferative Disorders-Research Consortium, New Approaches to Neuroblastoma Therapy Consortium, National Cancer Institute, M.D. Anderson Cancer Center, Children's Oncology Group |
| 6 | CP-690550 (tofacitinib, tasocitinib) |
reumatoidalne zapalenie stawów, łuszczycowe zapalenie stawów, łuszczyca zwykła, zesztywniające zapalenie stawów kręgosłupa, atopowe zapalenie skóry, wrzodziejące zapalenie jelita grubego, młodzieńcze idiopatyczne zapalenie stawów, choroba Leśniowskiego-Crohna | Pfizer, Shinshu University, Showa Inan General Hospital |
| 7 | CYT387 | pierwotna i wtórna mielofibroza | YM BioSciences Australia Pty |
| 8 | INCB018424 (ruxolitinib) |
pierwotna i wtórna mielofibroza, łuszczyca plackowata, rak prostaty z przerzutami, ostra białaczka szpikowa, ostra białaczka limfocytarna, zespół mielodysplastyczny, przewlekła białaczka szpikowa, czerwienica prawdziwa, nadpłytkowość samoistna, ostra białaczka, trombocytoza, gruczolakorak trzustki z przerzutami, szpiczak mnogi, reumatoidalne zapalenie stawów, obwodowy chłoniak T-komórkowy, nawracający rozlany chłoniak olbrzymiokomórkowy u dorosłych, nawracająca T-komórkowa białaczka/chłoniak u dorosłych, przewlekłe zespoły mieloproliferacyjne, białaczka, zespoły mielodysplastyczne, zespoły mielodysplastyczne/mieloproliferacyjne, nieokreślone dziecięce guzy lite | Incyte Corporation, M.D. Anderson Cancer Center, University of Nebraska, Novartis Pharmaceuticals, Children's Oncology Group, National Cancer Institute, GOELAMS |
| 9 | SB1518 (pacritinib) |
pierwotna i wtórna mielofibroza, czerwienica prawdziwa, nadpłytkowość samoistna, ostra białaczka szpikowa, przewlekła białaczka szpikowa, przewlekła białaczka mielomonocytowa, zespoły mielodysplastyczne, chłoniak Hodgkina, chłoniak z komórek płaszcza, chłoniak łagodny, chłoniak złośliwy, chłoniak B-komórkowy | S*Bio |
| 10 | TG02 | ostra białaczka szpikowa, ostra białaczka limfocytowa, przewlekła białaczka szpikowa, mielodysplazja wysokiego ryzyka, szpiczak mnogi | Tragara Pharmaceuticals |
| 11 | TG101348 (fedratinib) |
pierwotna i wtórna mielofibroza | TargeGen |
Literatura
- Adelaide, J.; Perot, C.; Gelsi-Boyer, V.; Pautas, C.; Murati, A.; Copie-Bergman, C.; Imbert, M.; Chaffanet, M.; Birnbaum, D.; Mozziconacci, M.J. A t(8;9) translocation with PCM1-JAK2 fusion in a patient with T-cell lymphoma. Leukemia, 2006, 20 (3), 536-537.
- Baxter, E.J.; Scott, L.M.; Campbell, P.J.; East, C.; Fourouclas, N.; Swanton, S.; Vassiliou, G.S.; Bench, A.J.; Boyd, E.M.; Curtin, N.; Scott, M.A.; Erber, W.N.; Green, A.R. Acquired mutation of the tyrosine kinase JAK2 in human myeloproliferative disorders. The Lancet, 2005, 365 (9464), 1054-1061.
- Bousquet, M.; Quelen, C.; De Mas, V.; Duchayne, E.; Roquefeuil, B.; Delsol, G.; Laurent, G.; Dastugue, N.; Brousset, P. The t(8;9)(p22;p24) translocation in atypical chronic myeloid leukaemia yields a new PCM1-JAK2 fusion gene. Oncogene, 2005, 24 (48), 7248-7252.
- Cirmena, G.; Aliano, S.; Fugazza, G.; Bruzzone, R.; Garuti, A.; Bocciardi, R.; Bacigalupo, A.; Ravazzolo, R.; Ballestrero, A.; Sessarego, M. A BCR-JAK2 fusion gene as the result of a t(9;22)(p24;q11) in a patient with acute myeloid leukemia. Cancer Genet. Cytogenet., 2008, 183 (2), 105-108.
- Funakoshi-Tago, M.; Tago, K.; Sumi, K.; Abe, M.; Aizu-Yokota, E.; Oshio, T.; Sonoda, Y.; Kasahara, T. The acute lymphoblastic leukemia-associated Jak2 L611S mutant induces tumorigenesis in nude mice. J. Biol. Chem., 2009, M808879200.
- Griesinger, F.; Hennig, H.; Hillmer, F.; Podleschny, M.; Steffens, R.; Pies, A.; Wörmann, B.; Haase, D.; Bohlander, S.K. A BCR–JAK2 fusion gene as the result of a t(9;22)(p24;q11.2) translocation in a patient with a clinically typical chronic myeloid leukemia. Genes. Chromosomes Cancer, 2005, 44 (3), 329-333.
- Lacronique, V.; Boureux, A.; Monni, R.; Dumon, S.; Mauchauffé, M.; Mayeux, P.; Gouilleux, F.; Berger, R.; Gisselbrecht, S.; Ghysdael, J.; Bernard, O.A. Transforming properties of chimeric TEL-JAK proteins in Ba/F3 cells. Blood, 2000, 95 (6), 2076-2083.
- Lee, J.W.; Kim, Y.G.; Soung, Y.H.; Han, K.J.; Kim, S.Y.; Rhim, H.S.; Min, W.S.; Nam, S.W.; Park, W.S.; Lee, J.Y.; Yoo, N.J.; Lee, S.H. The JAK2 V617F mutation in de novo acute myelogenous leukemias. Oncogene, 2006, 25 (9), 1434-1436.
- Levine, R.L.; Wadleigh, M.; Cools, J.; Ebert, B.L.; Wernig, G.; Huntly, B.J.P.; Boggon, T.J.; Wlodarska, I.; Clark, J.J.; Moore, S.; Adelsperger, J.; Koo, S.; Lee, J.C.; Gabriel, S.; Mercher, T.; D'Andrea, A.; Fröhling, S.; Döhner, K.; Marynen, P.; Vandenberghe, P.; Mesa, R.A.; Tefferi, A.; Griffin, J.D.; Eck, M.J.; Sellers, W.R.; Meyerson, M.; Golub, T.R.; Lee, S.J.; Gilliland, D.G. Activating mutation in the tyrosine kinase JAK2 in polycythemia vera, essential thrombocythemia, and myeloid metaplasia with myelofibrosis. Cancer Cell, 2005, 7 (4), 387-397.
- Lucet, I.S.; Fantino, E.; Styles, M.; Bamert, R.; Patel, O.; Broughton, S.E.; Walter, M.; Burns, C.J.; Treutlein, H.; Wilks, A.F.; Rossjohn, J. The structural basis of Janus kinase 2 inhibition by a potent and specific pan-Janus kinase inhibitor. Blood, 2006, 107 (1), 176-183.
- Malinge, S.; Ben-Abdelali, R.; Settegrana, C.; Radford-Weiss, I.; Debre, M.; Beldjord, K.; Macintyre, E.A.; Villeval, J.-L.; Vainchenker, W.; Berger, R.; Bernard, O.A.; Delabesse, E.; Penard-Lacronique, V. Novel activating JAK2 mutation in a patient with Down syndrome and B-cell precursor acute lymphoblastic leukemia. Blood, 2007, 109 (5), 2202-2204.
- Mark, H.F.L.; Sotomayor, E.A.; Nelson, M.; Chaves, F.; Sanger, W.G.; Kaleem, Z.; Caughron, S.K. Chronic idiopathic myelofibrosis (CIMF) resulting from a unique 3;9 translocation disrupting the janus kinase 2 (JAK2) gene. Exp. Mol. Pathol., 2006, 81 (3), 217-223.
- Mercher, T.; Wernig, G.; Moore, S.A.; Levine, R.L.; Gu, T.-L.; Fröhling, S.; Cullen, D.; Polakiewicz, R.D.; Bernard, O.A.; Boggon, T.J.; Lee, B.H.; Gilliland, D.G. JAK2T875N is a novel activating mutation that results in myeloproliferative disease with features of megakaryoblastic leukemia in a murine bone marrow transplantation model. Blood, 2006, 108 (8), 2770-2779.
- Murati, A.; Gelsi-Boyer, V.; Adelaide, J.; Perot, C.; Talmant, P.; Giraudier, S.; Lode, L.; Letessier, A.; Delaval, B.; Brunel, V.; Imbert, M.; Garand, R.; Xerri, L.; Birnbaum, D.; Mozziconacci, M.J.; Chaffanet, M. PCM1-JAK2 fusion in myeloproliferative disorders and acute erythroid leukemia with t(8;9) translocation. Leukemia, 2005, 19 (9), 1692-1696.
- Poitras, J.L.; Cin, P.D.; Aster, J.C.; DeAngelo, D.J.; Morton, C.C. Novel SSBP2-JAK2 fusion gene resulting from a t(5;9)(q14.1;p24.1) in pre-B acute lymphocytic leukemia. Genes. Chromosomes Cancer, 2008, 47 (10), 884-889.
- Reiter, A.; Walz, C.; Watmore, A.; Schoch, C.; Blau, I.; Schlegelberger, B.; Berger, U.; Telford, N.; Aruliah, S.; Yin, J.A.; Vanstraelen, D.; Barker, H.F.; Taylor, P.C.; O'Driscoll, A.; Benedetti, F.; Rudolph, C.; Kolb, H.-J.; Hochhaus, A.; Hehlmann, R.; Chase, A.; Cross, N.C.P. The t(8;9)(p22;p24) Is a Recurrent Abnormality in Chronic and Acute Leukemia that Fuses PCM1 to JAK2. Cancer Res., 2005, 65 (7), 2662-2667.
- Saharinen, P.; Vihinen, M.; Silvennoinen, O. Autoinhibition of Jak2 Tyrosine Kinase Is Dependent on Specific Regions in Its Pseudokinase Domain. Mol. Biol. Cell, 2003, 14 (4), 1448-1459.
- Schnittger, S.; Bacher, U.; Kern, W.; Schroder, M.; Haferlach, T.; Schoch, C. Report on two novel nucleotide exchanges in the JAK2 pseudokinase domain: D620E and E627E. Leukemia, 2006, 20 (12), 2195-2197.
- Wilks, A.F. The JAK kinases: Not just another kinase drug discovery target. Seminars in Cell & Developmental Biology, 2008, 19 (4), 319-328.