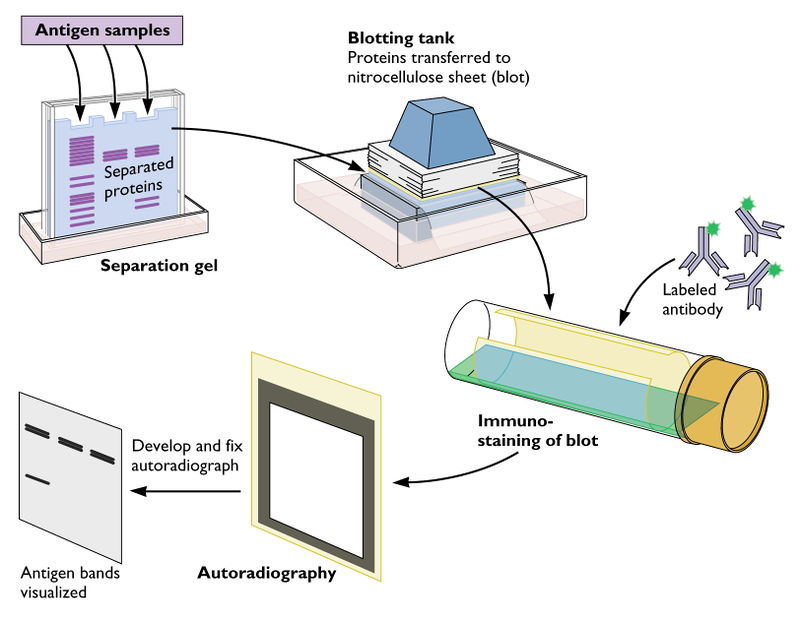
Western blot
Technika biologii molekularnej służąca do wykrywania i określania poziomu białek. Technika opiera się na denaturującym rozdziale w żelu poliakrylamidowym mieszaniny białek wyizolowanych z badanego materiału. W zależności od rodzaju materiału oraz frakcji białek (całokomórkowe, jądrowe, błonowe, mitochondrialne, cytoplazmatyczne itp.), do izolacji wykorzystuje się dedykowane bufory i procedury separacji, pozwalające na ich selektywne wyodrębnienie. Mieszaninę białek rozdziela się w żelu po uprzedniej termicznej denaturacji, tak aby białka przybrały formę liniową. Rozdział odbywa się pod względem masy cząsteczkowej białka. Po przeprowadzeniu rozdziału w żelu, pod wpływem pola elektrycznego (tzw. transfer) białka są przenoszone na membrany nitrocelulozowe lub PVDF. Detekcja wybranych białek odbywa się z jedno- lub dwustopniowo z wykorzystaniem specyficznych przeciwciał skierowanych przeciwko badanemu białku. Schematyczna ilustracja przebiegu analizy Western blot jest przedstawiona na rysunku 1.
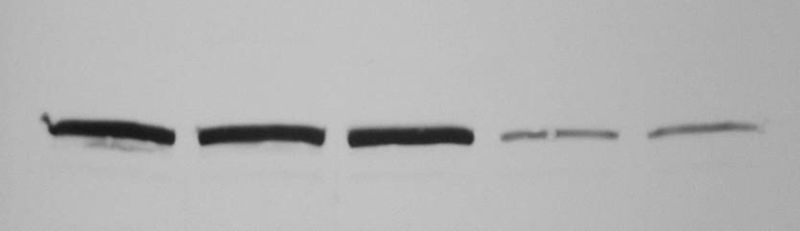
Przeciwciała wykorzystywane do immunoblotingu są wyznakowane peroksydazą chrzanową (HRP), biotynylowane lub wybarwione fluorochromem. Najczęściej w badaniach wykorzystuje się przeciwciała sprzężone z peroksydazą chrzanową (HRP). Towarzysząca reakcji HRP z substratem odczynnika do wywoływania luminescencja, powoduje zaczernienie kliszy RTG w miejscu przyłączenia przeciwciała i wizualizuje wykryte białko w postaci prążka. Ilustracja przykładowego wyniku analizy Western blot jest przedstawiona na rysunku 2.
Różnice w intensywności wykrytych prążków są poddawane analizie densytometrycznej z wykorzystaniem dedykowanych oprogramowań komputerowych. Dzięki ilościowej ocenie otrzymanego obrazu, przeliczając odpowiednio otrzymane wartości względem siebie, można ocenić zmiany w poziomie ekspresji białka w poszczególnych próbkach.
Literatura