VAP-1
Naczyniowa proteina adhezyjna 1 (VAP-1) to homodimeryczną glikoproteiną o masie około 180 kDa, która pośredniczy w przyłączaniu limfocytów do śródbłonka naczyń krwionośnych. Dwie podjednostki łączy ze sobą wiązanie disiarczkowe. Ze względu na swoją budowę przestrzenną, VPA-1 klasyfikuje się jako białko przezbłonowe typu 2, zbudowane z 764 aminokwasów, w strukturze którego wyróżniamy krótką N-domenę cytoplazmatyczną, pojedynczą domenę przezbłonową oraz dużą C-końcową domenę pozakomórkową. W każdej z podjednostek występuje 6 miejsc glikozylacji. W N-glikozylowanych pochodnych VAP-1 znajduję się kwas sialowy, jednakże struktura łańcuchów N-glikozylowanych jest zróżnicowana tkankowo i przypuszcza się, że ma wpływ na funkcje białka. Jak wykazały badania, pozbawieni glikoproteiny obecności reszt kwasu sjalowego blokowało adhezję limfocytów do śródbłonka.
Konstytutywna ekspresja VAP-1 jest obecna w żyłkach o wysokim śródbłonku (HEV), które występują w obwodowych narządach limfatycznych i wątrobie. Jego obecność stwierdza się także w mięśniach gładkich oraz adipocytach. Eksprymowany VAP-1 we wnętrzu komórki jest zlokalizowany w ziarnistościach cytoplazmatycznych odmiennych od ciałek Weibela-Pallade’a a w warunkach indukcji stanu zapalnego ulega translokacji na powierzchnię błony komórkowej. Czynniki indukujące ekspresję VAP-1 nie zostały zidentyfikowane, jednakże na podstawie analizy sekwencji w rejonie paromotorowym genu postuluje się udział czynnika transkrypcyjnego NFkB aktywowanego z kolei pod wpływem działania TNFalfa. Dotychczas stwierdzono wzrost ekspresji VAP-1 w wielu stanach chorobowych: zapaleniu stawów, zapaleniu wątroby, dermatozach, stanach zapalnych jelit.
VAP-1 jest cząsteczką, która wykazuje podwójne działanie. Ma bowiem właściwości cząsteczki adhezyjnej i reguluje wiązanie się limfocytów T do śródbłonka. Z drugiej zaś jest bierze udział w procesie oksydacyjnej deaminacji z preferencją substratową do beznylaminy i metylaminy przez VAP-1. Ponadto obie funkcje białka są ze sobą powiązane i aktywność enzymatyczna bezpośrednio koreluje ze stopniem wiązania limfocytów T. Schematyczna ilustracja procesu wiązania limfocytu T przy udziale VAP-1 jest przedstawiona na Rysunku 1.
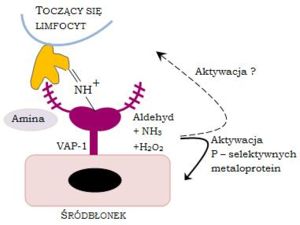
Jak wspomniano powyżej, N-glikozylowany łańcuch VAP-1 zawierajacy kwas sjalowy (fioletowy kolor) wiąże się z lektyno-podobną molekułą zlokalizowaną na powierzchni limfocytu T (kolor żółty). Drugim możliwym mechanizmem wiązania jest wykorzystanie przez VAP-1 zewnętrznej aminy limfocytu jako substratu reakcji oksydacyjnej deaminacji czego rezultatem jest uformowanie przejściowego wiązania kowalencyjnego pomiędzy komórką śródbłonka i limfocytem. Wiązania oligosacharydu i zasady Schiffa mogą być również zaangażowane w rozdzielaniu molekuł na powierzchni limfocytu lub jeśli molekularny typ lektyny występujący na powierzchni limfocytu również zawiera aminę dla VAP-1, to te same cząsteczki mogą być użyte w obu krokach.
Piśmiennictwo:
- http://www.sciencedirect.com/science/article/pii/S1471490601018701
- http://www.bioorganic.ch.pwr.wroc.pl/student/index.php/Bioinformatyka_amine_oxidase_%28copper-containing%29_%28histaminase%29_EC_1.4.3.6_Article
- Marttila-Ichihara F, Smith DJ, Stolen C, Yegutkin GG, Elima K, Mercier N, "Vascular amine oxidases are needed for leukocyte extravasation into inflamed joints in vivo", Arthritis Rheum Vol. 54 ,pp.2852–62, 2006
- S.Jalkanen, M.Salmi, "Cell serface monoamine oxidases: enzymes in search of a function", The EMBO Jurnal, Vol. 20, No. 15 pp. 3893-3901, 2001