Sekwencjonowanie
Sekwencjonowanie DNA - technika biologii molekularnej polegająca na odczytywaniu kolejności nukleotydów w cząsteczce DNA.
I generacja
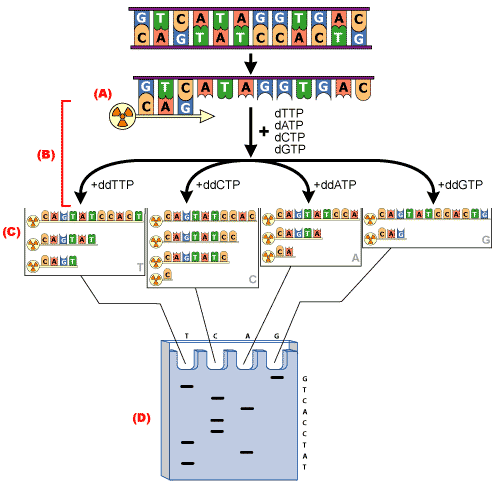
Historycznie, metoda sekwencjonowania, oparta na syntezie DNA z udziałem polimerazy DNA, została opracowana przez Sanger’a w 1977 roku. W metodzie Sanger’a mieszaninę reakcyjną dzieli się na 4 odrębne probówki a do każdej dodaje inny dNTP – dATP, dTTP, DTP, DTP. Poza dNTP do reakcji dodaje się niewielką ilość dideoksynukleotydów ddNTP –odpowiednio ddATP, ddTTP, ddCTP, ddGTP, które są wbudowywane w syntetyzowaną nić DNA. Dołączenie ddNTP uniemożliwia jednak dalsze wydłużanie nici. W ten sposób w powstaje mieszanina fragmentów DNA o różnej długości, zakończonych specyficznym nukleotydem. Mieszaninę produktów rozdziela się następnie elektroforetycznie na żelupoliakrylamidowym i odczytując od dołu rozdziału, ustala sekwencję powstałej nici DNA. Schematyczna ilustracja sekwencjonowania metodą Sanger’a jest przedstawiona na rysunku 1.
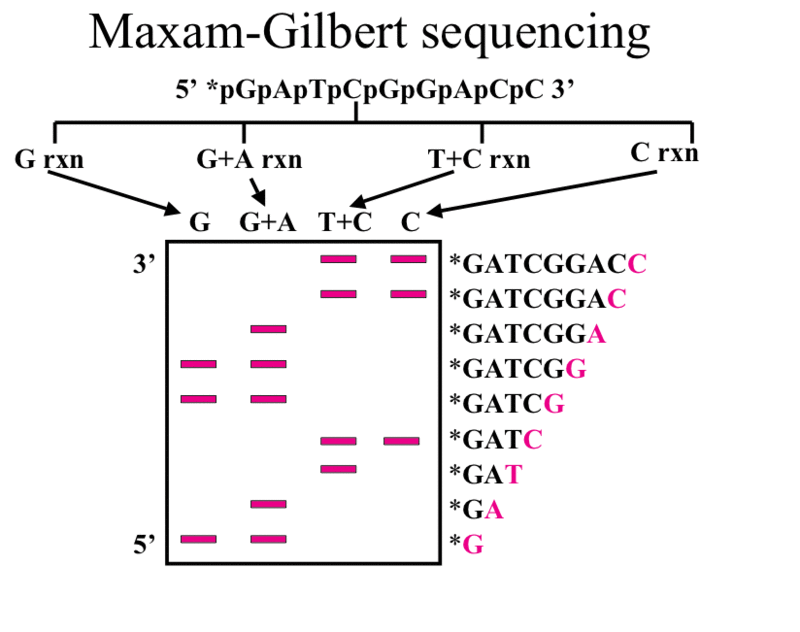
Drugą, alternatywną metodą sekwencjonowania DNA jest metoda chemicznej degradacji Maxama-Gilberta. Metoda ta opiera się na wyznakowaniu promieniotwórczym izotopem 5’ końca DNA a następnie degradacji cząsteczki w 4 odrębnych reakcjach z wykorzystaniem 4 mieszanin odczynników. W pierwszym etapie reakcji odbywa się chemiczna modyfikacja zasad azotowych danego nukleotydu. W miejscu pozbawionym zasad nić ulega pęknięciu za zmodyfikowanym nukleotydem. Do modyfikacji G (guanina) stosuje się mieszaninę piperydyny i siarczanu dimetylu, dla par A+G (adenina i guanina) – siarczan dimetylu, piperydynę oraz kwas mrówkowy, dla C (cytozyna) – hydrazynę/chlorek sodu i piperydynę oraz dla C+T (cytozyna i tymina) – hydrazynę i piperydynę. W wyniku reakcji chemicznej powstają fragmenty DNA wyznakowane na 5’ końcu. Ponieważ dana zasada występuje w łańcuchu wiele razy, w probówce otrzymujemy mieszaninę wielu fragmentów o różnej długości. Podobnie jak w metodzie Sanger’a, fragmenty z czterech oddzielnych reakcji rozdziela się elektroforetycznie na żelu i przy pomocy autoradiografii uwidacznia łańcuchy DNA. Uwidocznione prążki odpowiadają fragmentom DNA posiadającym na 3’ końcu określoną zasadę. Schematyczna ilustracja metody jest przedstawiona na rysunku 2.
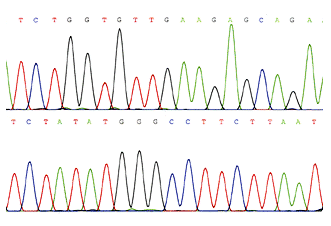
Najpowszechniej obecnie wykorzystywane sekwencjonowanie automatyczne, opiera się na znakowaniu fluorescencyjnym. Każdy z dNTP jest znakowany innym fluorochromem, który ma odmienną falę wzbudzenia. Dzięki temu, iż detektor posiada zdolność rozróżnienia poszczególnych znaczników fluorescencyjnych można przeprowadzić elektroforezę na jednej ścieżce żelu poliakrylamidowego a sekwencja może być odczytywana bezpośrednio w trakcie trwania rozdziału. Wynik jest przedstawiany przez program w postaci 4-kolorowego chromatogramu DNA, gdzie każdy pik reprezentuje zasadę DNA. Przykład wyniku sekwencjonowania ilustruje rysunek 3.
Sekwencjonowanie nowej generacji (NGS, ang. Next Generation Sequencing) to grupa metod pozwalających na wielkoskalowe ustalanie sekwencji genomu, epigenomu, transkryptomu (RNA-Seq), badanie interakcji białka z DNA (ChIP-sequencing). Opracowanie metod wielkoskalowych pozwoliło na znaczne obniżenie kosztów uzyskiwania sekwencji całych genomów.
II generacja
Metody wchodzące w skład tej grupy, pomimo różnienia się zastosowaną metodologią (np. zastosowane reakcje enzymatyczne), opierają się o podobny pomysł. Przygotowanie biblioteki następuje poprzez fragmentację DNA, po której następuje in vitro ligacja do adapterów. Amplikony PCR pochodzą z pojedynczych cząsteczek z biblioteki i są przestrzennie oddzielone od siebie nawzajem, w jednym miejscu na planarnym substracie (bridge PCR, polonie in situ) lub na mikronowej wielkości kulkach (PCR emulsyjny). Wymienione niżej metody opierają się o sekwencjonowanie poprzez syntezę, tj, wielokrotne wydłużanie sekwencji na podstawie matrycy ze starterem, przy pomocy polimerazy lub ligazy.
Metody sekwencjonowania II generacji zaproponowały szereg ulepszeń (w porównaniu do metod I generacji):
a) biblioteki konstruuje się in vitro, in vitro jest również przeprowadzana amplifikacja klonalna (w porównaniu do żmudnego transformowania E.coli i selekcję kolonii zastosowane w sekwencjonowaniu genomu ludzkiego metodą tradycyjną); b) platformy do sekwencjonowania oparte o macierze pozwalają na jednoczesne sekwencjonowanie znacznie większej ilości (setki milionów) odczytów na powierzchni zaledwie kilku cm2) w porównaniu do stosowanych wcześniej kapilar; c) jednoczesna immobilizacja sekwencjonowanych cząsteczek na jednej powierzchni umożliwia przeprowadzanie reakcji enzymatycznych w małej jednostkowej objętości, co w konsekwencji znacznie obniża koszty sekwencjonowania.
Wady sekwencjonowania II generacji (w porównaniu do sekwencjonowania metodą Sangera):
a) dużo krótsze odczyty (kilkanaście do 250 bp. w porównaniu do 300-1000 bp metodą Sangera); b) gorsza jakość i dokładność odczytów (ogólnie ok. 10-krotnie mniej dokładne od metody Sangera); c) dużo trudniejsza algorytmicznie analiza danych.
Platformy dla technik II generacji
Roche 454 HiSeq Illumina SOLiD Applied Biosystems Polonator (Dover/Harvard) HeliScope Single Molecule Sequencher
III generacja
Ion Torrent Life Technologies Helicos BioSciences Pacific Bioscience Oxford Nanopore Complete Genomics