Koncepcja proleków
„Prolekami” określa się farmakologicznie nieaktywne pochodne leków (tj. substancji farmakologicznie aktywnych) powstałe po przyłączeniu do nich (przy pomocy wiązania kowalencyjnego) innych substancji. Po podaniu do organizmu lek uwalniany jest z proleku w wyniku enzymatycznej lub nieenzymatycznej reakcji (np. reakcji hydrolizy) 1. Koncepcję proleków (zwanych uprzednio także „lekami latencjalizowanymi”, „pochodnymi bioodwracalnymi”, bądź „kongenerami”) zaproponowali w roku 1950 Albert i wsp. 2, ale pierwotnie tę ideę obrazowano jako „lek w czapce” 2, albo „lek w masce” 3 (Rys. 1). Odpowiednio skonstruowany prolek umożliwić może podawanie dożylne leku słabo rozpuszczalnego w wodzie albo łatwiejsze przechodzenie leku przez błony komórkowe do wnętrza komórek docelowych, może wydłużyć czas półtrwania leku w osoczu krwi, zwiększyć jego wychwyt przez komórki docelowe, bądź zmniejszyć toksyczność obwodową.
Terminu „prolek” używa się niekiedy również do określenia substancji, która jest farmakologicznie nieaktywna i dopiero w organizmie ulega aktywacji do formy aktywnej w wyniku przemian metabolicznych. Wg takiej rozszerzonej definicji prolekami byłyby więc również cytotoksyczne pochodne nukleozydowe podlegające wewnątrzkomórkowej aktywacji przez fosforylację. W konstruowaniu proleków jednym z najbardziej popularnych rozwiązań jest tworzenie pochodnych estrowych poprzez przyłączenie „maski” zawierającej grupę karboksylową do leku zawierającego grupę hydroksylową, bądź odwrotnie – leku zawierającego grupę karboksylową do „maski” zawierającej grupę hydroksylową. Zamiast „maski” można zastosować drugi lek – wówczas cząsteczka proleku zawiera dwie cząsteczki farmakologicznie aktywne (Ryc. 2). W warunkach fizykochemicznych przeważających w organizmie (roztwór wodny, temperatura 37oC, pH w zakresie 5-8) wiązanie estrowe R1–CO-O-R2 jest zazwyczaj stabilne, ale podlega łatwej hydrolizie pod wpływem esteraz, których aktywność wewnątrz komórek jest wysoka. Estryfikacja jest często wykorzystywana do syntezy proleków nukleozydowych, gdyż nukleozydy mają grupy hydroksylowe, a niektóre z nich (szczególnie grupa –OH w pozycji 5’) dość łatwo poddają się estryfikacji. Przykładem takich pochodnych nukleozydowych są estry AZT.
AZT (3’-azido-2’,3’-dideoksytymidyna, INN: zidovudine) jest inhibitorem odwrotnej transkryptazy wirusów HIV (ang. human immunodeficiency virus, ludzki wirus niedoboru odporności) i pierwszym lekiem, który znalazł praktyczne i powszechne zastosowanie w profilaktyce i leczeniu AIDS (ang. acquired immunodefficiency syndrome, zespół nabytego niedoboru odporności) 4. Skuteczność AZT jest jednak ograniczona, m.in. dlatego, że jako substancja hydrofilna ma trudności z przechodzeniem przez bariery biologiczne, zwłaszcza przez barierę krew-mózg. Zsyntetyzowano wiele proleków AZT, wśród których najliczniejszą grupę (ponad 200) stanowią estry, omówione w monograficznej pracy Paranga 5. Są wśród nich estry kwasów karboksylowych, które są hydrolizowane do AZT, oraz estry fosforanowe hydrolizowane do monofosforanu AZT (AZT-MP). Dla przykładu, AZT estryfikowano kwasami rozpuszczalnymi w tłuszczach dla uczynienia cząsteczki lipofilową i – co za tym idzie – nadania jej zdolności penetracji przez bariery biologiczne. Po estryfikacji długołańcuchowymi nienasyconymi kwasami alifatycznymi (takimi jak kwas retinoilowy, czy γ-linolenowy) oprócz polepszenia penetracji leku przez błony komórkowe uzyskano wzmocnienie przeciwirusowej aktywności AZT. Estryfikacja AZT aminokwasami miała na celu zwiększenie wychwytu nukleozydu przez komórki docelowe poprzez wykorzystanie układu aktywnego transportu aminokwasów 6. W celu zwiększenia penetracji leku przez barierę krew-mózg skonstruowano tzw. „system chemicznego dostarczania leku” (ang. chemical drug delivery system), którym był ester AZT i kwasu 1,4-dihydro-1-metylo-3-nikotynowego – substancji, która przechodzi przez tę barierę w drodze transportu aktywnego 7. Ten prolek AZT miał wybiórczo gromadzić się w mózgu, ulegając tam hydrolizie i aktywacji – okazał się jednak niestabilny in vitro 8. Aktywacja AZT w komórkach jest, podobnie jak w przypadku kladrybiny, zależna od pierwszego etapu fosforylacji katalizowanego przez dCK. Wprowadzanie do wnętrza komórek monofosforanu AZT pozwoliłoby ominąć ten etap. Jednakże nukleotydy nie przechodzą przez błony komórkowe, a ponadto na powierzchni komórek i w płynach zewnątrzkomórkowych obecne są niespecyficzne enzymy defosfosforylujące 9. Problem ten rozwiązano przez zsyntetyzowanie innego typu estrowych pochodnych AZT, a mianowicie estrów monofosforanu AZT. Estry tego rodzaju mogą przechodzić przez błony komórkowe, a AZT-MP jest chroniony przed enzymami defosforylującymi przez drugi składnik przyłączony do grupy fosforanowej 10. Podobny mechanizm działania może być zaproponowany w przypadku związków chemicznych o potencjalnych właściwościach przeciwnowotworowych. Estry dA (2’-deoksyadenozyna; naturalny nukleozyd) bądź 2CdA (2-chloro-2’-deoksyadenozyna, kladrybina; lek przeciwnowotworowy, pochodna dA) mogą zostać wykorzystane do selektywnego dostarczania substancji farmakologicznie czynnych o stukturze kwasów karboksylowych do komórek posiadających wysoką aktywność, odpowiednio, dCK i ADA – a więc do komórek limfoidalnych (w tym białaczkowych bądź chłoniakowych). Byłoby to możliwe, gdyby wspomniane estry penetrowały do wnętrza wyżej wspomnianych komórek i ulegały tam hydrolizie uwalniając nukleozyd i kwas karboksylowy (Rys. 3). Wówczas uwalniany z estru nukleozyd byłby z środowiska wewnątrzkomórkowego szybko usuwany – dA byłaby dezaminowana przez ADA do 2’-deoksyinozyny, natomiast 2CdA byłaby fosforylowana przez dCK. W obu przypadkach usuwanie nukleozydu uwolnionego z estru powinno prowadzić do wewnątrzkomórkowego gromadzenia drugiego produktu hydrolizy – kwasu karboksylowego – i potęgowania jego aktywności. W przypadku estrów 2CdA i kwasów organicznych o właściwościach cytotoksycznych można by również oczekiwać addytywności (lub nawet synergizmu).
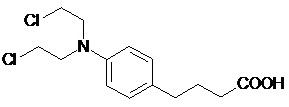
Przykładem kwasu karboksylowego o właściwościach przeciwnowotworowych jest chlorambucyl (INN: chlorambucil, CLB) będący nazwą farmaceutyczną kwasu N,N‑bis-(2‑chloroetylo)-p-aminofenylomasłowego (Rys. 4). Substancja ta, zsyntetyzowana po raz pierwszy przez Everetta i wsp. w 1953 r. 11, należy do cytotoksycznych leków alkilujących.
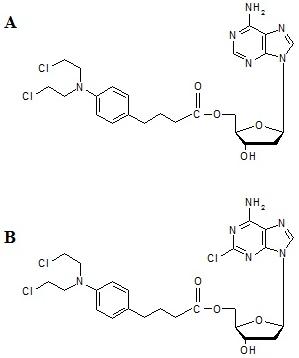
CLB, który najczęściej podawany jest doustnie, jest prawie całkowicie metabolizowany w wątrobie na drodze β-oksydacji do również aktywnego metabolitu, iperytu kwasu fenylooctowego 12. Ten ostatni penetruje do komórek w drodze dyfuzji biernej, a następnie wchodzi w reakcje z makrocząsteczkami (DNA, RNA, białkami) 13. Kowalencyjne przyłączenie leku do DNA (preferencyjnie do atomu azotu N7 pierścienia guaniny lub atomu azotu N3 pierścienia adeniny, lub tworzenie wiązań pomiędzy atomami azotu N7 cząsteczek guaniny znajdujacymi się na komplementarnych niciach podwójnej helisy DNA) prowadzi do zaburzenia odczytu kodu genetycznego 14,15 powodując śmierć komórki na drodze apoptozy 16. Po uzyskaniu zachęcających rezultatów doświadczeń na hodowlach komórkowych i zwierzętach, którym wszczepiano nowotwory różnych typów, CLB już w 1957 r. został zastosowany w badaniach klinicznych 17. W 1961 r. Galton i wsp., a cztery lata później Ezdlini i wsp., przedstawili wyniki prób leczenia CLB pacjentów z przewlekłą białaczką limfatyczną 18 lub chłoniakami 19. Pozytywne wyniki tych badań spowodowały, że CLB w krótkim okresie czasu stał się jednym z podstawowych leków stosowanych w leczeniu chorób układu białokrwinkowego 20. Jest on obecnie powszechnie stosowany w leczeniu ziarnicy złośliwej, chłoniaków nieziarniczych i przewlekłej białaczki limfatycznej B-komórkowej 21. CLB próbowano stosować również w leczeniu chorób, w których wyleczenie lub redukcję objawów chorobowych osiąga się poprzez immunosupresję 22-29. Jednak raport Międzynarodowej Agencji d/s Badań nad Rakiem z 1987 r. wykazał, że u części osób leczonych chlorambucylem z powodów innych niż choroba nowotworowa rozwijała się ostra białaczka szpikowa 30, a badania na zwierzętach potwierdziły, że lek ten jest silnym karcinogenem 31. Z tego względu CLB jest lekiem stosowanym głównie u pacjentów w zaawansowanych stadiach chorób nowotworowych. Rys. 5 przedstawia 5’-O-estry 2’-deoksyadenozyny i 2-chloro-2’-deoksyadenozyny z chlorambucylem (dA‑CLB, 2CdA-CLB). Obie te substancje były testowane in vitro i in vivo w kierunku właściwości przeciwnowotworowych.
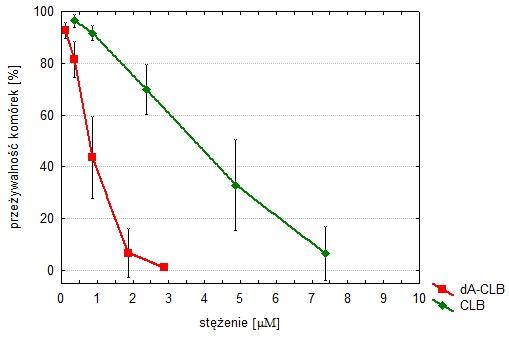
Ustalono, że oba estry są stabilne w środowisku wodnym o pH w zakresie 5-8, a jednocześnie podatne na enzymatyczną hydrolizę w obecności esterazy wątrobowej i wewnątrzkomórkowej. Oba estry są aktywne przeciwnowotworowo wobec komórek limfoidalnych (białaczki i chłoniaki). W szczególności ester dA-CLB (połączenie nietoksycznego nukleozydu z cytostatykiem) okazał się bardziej cytotoksyczny od chlorambucylu (Rys. 6). Badania przeprowadzone na dojrzałych samicach myszy szczepu BALB/c w kierunku toksyczności in vivo obu związków wykazały wartości LD50 (ang. lethal dose zabijająca 50% populacji; obliczone metodą regresji logarytmiczno-probitowej): 159 µmol/kg m.c. dla CLB i 188 µmol/kg m.c. dla dA-CLB (p<0,05). Oznacza to, że wolny chlorambucyl jest molowo bardziej toksyczny, niż jego ester z 2’-deoksyadenozyną. Co więcej, u zwierząt, którym podawano CLB, występowały drgawki (które są wykładnikiem neurotoksyczności), natomiast tego objawu nie stwierdzono u zwierząt, którym podawano dA-CLB 32.
Powyższe rezultaty badań wskazujące na większą toksyczność estru względem komórek nowotworowych, a mniejszą wobec komórek nienowotworowych potwierdzają słuszność założonej koncepcji proleku.