Białka SMAD
Białka SMAD to grupa białek zaangażowanych w przekaźnictwo sygnału indukowanego przez cytokinę TGF-beta. Białka z rodziny SMAD można podzielić na trzy grupy:
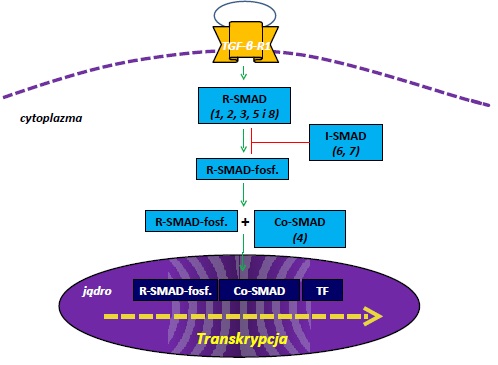
- Białka aktywowane przez receptor R-SMAD: biorą udział w przekazywaniu sygnału do jądra komórkowego. Do grupy tej należą biała SMAD-1, -2, -3, -5, -8. Posiadają one podobną strukturę chemiczną, na którą składają się dwie konserwatywne domeny N- i C-końcową, nazwane MH-1 i MH-2. Domeny oddziela sekwencja łącznikowa. Domena N-końcowa wykazuje aktywność wiązania DNA, podczas gdy domena C-końcowa odpowiada za oddziaływania z innymi białkami. Nieaktywne R-SMAD pozostają w cytoplazmie a w wyniku aktywacji szlaku TGF-beta ulegają translokacji do jądra komórkowego.
- Białka pośredniczące Co-SMAD: SMAD-4. Ma możliwość tworzenia połączeń z białkami R-SMAD, umożliwiając ich translokację z cytoplazmy do jądra komórkowego.
- Białka inhibitorowe I-SMAD: SMAD-6, -7. Posiadają w swojej strukturze jedynie domenę C-końcową MH2. Są zlokalizowane w jądrze komórkowym i wykazują działanie antagonistyczne w stosunku do białek dwóch pierwszych grup.
Schematyczna ilustracja funkcji różnych białek SMAD jest przedstawiona na Rysunku 1.
Udział białek SMAD w szlaku TGF-beta
Cytokina TGF-beta oddziałuje na komórkę za pośrednictwem trzech typów receptora: TNG-betaRI, TGF-betaRII i TGF-betaRIII. TGB-betaRI jest glikoproteiną, w obrębie której występuje 7 podgrup: od Alk-1 do Alk-7. Receptor typu I ma aktywność kinazy serynowo-treoninowej (rejon transbłonowy) oraz domeny wiążącej ligand. W strukturze TNG-betaRI wystepuje także zewnątrzkomórkowa domena –glicynowo-serynowa, w której zachodzi aktywacja receptora. TGF-beta wykazuje duże powinowactwo do receptora typu II i cytokina początkowo wiąże się z tym receptorem. Następnie kompleks ligand-receptor typu II łączy się z receptorem typu I, w wyniku czego powstaje kompleks dwóch cząsteczek TGF-betaRI i TGF-betaRII. Po połączeniu receptor typu II fosforyluje reszty seryny i treoniny. Aktywowany receptor fosforyluje białka R-SMAD, które ulegają translokacji do jądra komórkowego. W jądrze komórkowym, wchodząc w kompleksy z innymi białkami, regulując procesy transkrypcji genów. Białka o charakterze represorów lub aktywatorów są niezbędne do regulacji genów przez SMAD, które nie wykazują dużej swoistości wiązania DNA. Rola białek SMAD polega na wyborze transkrypcyjnych koaktywatorów lub korepresorów. Białka SMAD-1, -5, -8 pośredniczą głównie w przekazywaniu sygnału czynnika morfogenetycznego kości BMP, a SMAD-2 i -3 zależą głównie od TGFbeta. Natomiast SMAD-4 jest białkiem łączącym oba szlaki. Białka I-SMAD negatywnie regulują sygnał nTGF-beta poprzez współzawodnictwo z białkami R-SMAD o miejsce wiązania z receptorem lub białkami Co-SMAD. Z kolei SMAD-7 przyłącza do receptorów TGF-beta ligazę ubikwitynową, umożliwiając jego proteosomalną i lizosomalną degradację receptorów. SMAD-6 hamuje natomiast przekazywanie sygnały BMP. SMAD-6 niszczy kompleks SMAD-1-Co-SMAD i utworzenie nieaktywnego kompleksu SMAD-1-SMAD-6.
Piśmiennictwo:
- Witkowska i Smolewski, Post Hig Med Dosw 2014, 68: 301-309
- http://www.ncbi.nlm.nih.gov/pubmed/11940386
- http://www.ncbi.nlm.nih.gov/pubmed/10879283