Beatapwiki (dyskusja | edycje) (→TRAIL) |
(→TRAIL) |
||
| Linia 2: | Linia 2: | ||
TRAIL z ang. TNF-related apoptosis inducing factor; cytokina z rodziny TNFa, należąca do tzw. ligandów śmierci. Za pośrednictwem swoistych receptorów błonowych TRAIL-R1 (DR 4) i TRAIL-R2 (DR 5), indukuje powstawanie DISC (death-inducing signaling complex), na który składają się białka FADD i prokaspaza 8. Rekrutacja prokaspazy 8 indukuje jej autokatalityczną aktywację. Aktywna kaspaza 8 aktywuje następczo kaspaza wykonawcze i prowadzi do egzekucji apoptozy zewnątrzpochodnej. Indukcję apoptozy zewnątrzpochodnej przez TRAIL ilustruje schemat 1. | TRAIL z ang. TNF-related apoptosis inducing factor; cytokina z rodziny TNFa, należąca do tzw. ligandów śmierci. Za pośrednictwem swoistych receptorów błonowych TRAIL-R1 (DR 4) i TRAIL-R2 (DR 5), indukuje powstawanie DISC (death-inducing signaling complex), na który składają się białka FADD i prokaspaza 8. Rekrutacja prokaspazy 8 indukuje jej autokatalityczną aktywację. Aktywna kaspaza 8 aktywuje następczo kaspaza wykonawcze i prowadzi do egzekucji apoptozy zewnątrzpochodnej. Indukcję apoptozy zewnątrzpochodnej przez TRAIL ilustruje schemat 1. | ||
| − | [[Image: | + | [[Image:TRIAL.jpg|thumb|center|800px| Schemat 1.(źródło: http://www.nature.com/nrc/journal/v1/n2/fig_tab/nrc1101-142a_F3.html)]] |
Wykazano obecność dodatkowych swoistych receptorów dla TRAIL, tzw. TRAIL-R3, TRAIL-R4 i TRAIL-R5. Receptory te są jednak afunkcjonalne i nie indukują apoptozy w komórkach. Receptory TRAIL-R3 i TRAIL-R5 nie posiadają tzw. domeny śmierci (DD, death domain) w części wewnątrzkomórkowej receptora, która umożliwiała wiązanie białka FADD. Receptor TRAIL-R4 z kolei zawiera skróconą postać domeny śmierci, która także nie spełnia swojej fizjologicznej funkcji. Wysoką ekspresję niefunkcjonalnych receptorów dla liganda TRAIL wykryto w wielu typach komórek nowotworowych. Uważa się, iż jest to jedna z strategii warunkująca „unik immunologiczny” komórek nowotworowych i brak reakcji komórek na indukcję apoptozy przez cytokiny komórek immunologicznych. | Wykazano obecność dodatkowych swoistych receptorów dla TRAIL, tzw. TRAIL-R3, TRAIL-R4 i TRAIL-R5. Receptory te są jednak afunkcjonalne i nie indukują apoptozy w komórkach. Receptory TRAIL-R3 i TRAIL-R5 nie posiadają tzw. domeny śmierci (DD, death domain) w części wewnątrzkomórkowej receptora, która umożliwiała wiązanie białka FADD. Receptor TRAIL-R4 z kolei zawiera skróconą postać domeny śmierci, która także nie spełnia swojej fizjologicznej funkcji. Wysoką ekspresję niefunkcjonalnych receptorów dla liganda TRAIL wykryto w wielu typach komórek nowotworowych. Uważa się, iż jest to jedna z strategii warunkująca „unik immunologiczny” komórek nowotworowych i brak reakcji komórek na indukcję apoptozy przez cytokiny komórek immunologicznych. | ||
Aktualna wersja na dzień 07:44, 2 lis 2012
TRAIL
TRAIL z ang. TNF-related apoptosis inducing factor; cytokina z rodziny TNFa, należąca do tzw. ligandów śmierci. Za pośrednictwem swoistych receptorów błonowych TRAIL-R1 (DR 4) i TRAIL-R2 (DR 5), indukuje powstawanie DISC (death-inducing signaling complex), na który składają się białka FADD i prokaspaza 8. Rekrutacja prokaspazy 8 indukuje jej autokatalityczną aktywację. Aktywna kaspaza 8 aktywuje następczo kaspaza wykonawcze i prowadzi do egzekucji apoptozy zewnątrzpochodnej. Indukcję apoptozy zewnątrzpochodnej przez TRAIL ilustruje schemat 1.
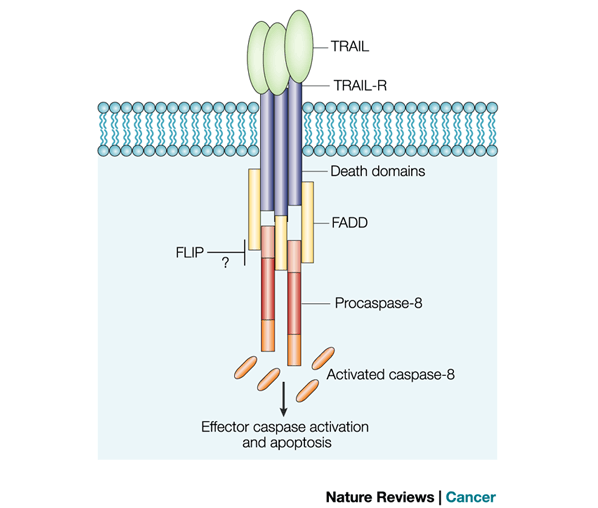
Wykazano obecność dodatkowych swoistych receptorów dla TRAIL, tzw. TRAIL-R3, TRAIL-R4 i TRAIL-R5. Receptory te są jednak afunkcjonalne i nie indukują apoptozy w komórkach. Receptory TRAIL-R3 i TRAIL-R5 nie posiadają tzw. domeny śmierci (DD, death domain) w części wewnątrzkomórkowej receptora, która umożliwiała wiązanie białka FADD. Receptor TRAIL-R4 z kolei zawiera skróconą postać domeny śmierci, która także nie spełnia swojej fizjologicznej funkcji. Wysoką ekspresję niefunkcjonalnych receptorów dla liganda TRAIL wykryto w wielu typach komórek nowotworowych. Uważa się, iż jest to jedna z strategii warunkująca „unik immunologiczny” komórek nowotworowych i brak reakcji komórek na indukcję apoptozy przez cytokiny komórek immunologicznych.
Literatura
- Kimberley F, Screaton G. Following a TRAIL: Update on a ligand and its five receptors. Cell Res 2004; 14:359-72.
- Srivastava RK. TRAIL/Apo2-L: mechanisms and clinical applications in cancer. Neoplasia 2001; 3:335-46.
- Falschlehner C, Emmerich C, Gerlach B, Walczak H. TRAIL signalling: decisions between life and death. Int J Biochem Cell Biol 2007; 39:1462-1475.