(→Kinazy JAK) |
(→Kinazy JAK) |
||
| Linia 4: | Linia 4: | ||
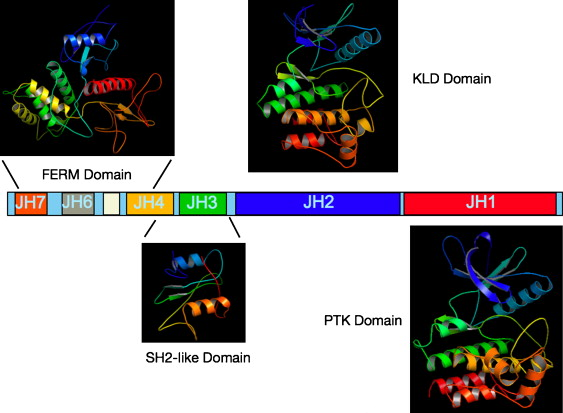
[[Image: JAK-Rysunek1.png|thumb|center|600px|Schemat 1: Struktura domenowa kinaz JAK, PTK - Protein Tyrosine Kinase, KLD - Kinase-like Domain (żródło: A.F.Wilks ''Seminars in Cell & Developmental Biology'' 19(2008): 319-328)]] | [[Image: JAK-Rysunek1.png|thumb|center|600px|Schemat 1: Struktura domenowa kinaz JAK, PTK - Protein Tyrosine Kinase, KLD - Kinase-like Domain (żródło: A.F.Wilks ''Seminars in Cell & Developmental Biology'' 19(2008): 319-328)]] | ||
| − | {|class="wikitable" style="text-align:center; font-size:75%; float: right; border: | + | {|class="wikitable" style="text-align:center; font-size:75%; float: right; border: 1px" |
| + | {{clear}} | ||
|+ Tabela 1 | |+ Tabela 1 | ||
!kinaza JAK | !kinaza JAK | ||
Wersja z 11:53, 8 maj 2014
Kinazy JAK
Kinazy JAK (Janus Kinase) należą do rodziny eukariotycznych niereceptorowych tyrozynowych kinaz białkowych. Ludzkie kinazy JAK1 oraz JAK2 zostały odkryte przez Wilksa w 1989 roku (Wilks 1898), który zidentyfikował ich sekwencje kodujące w oparciu o tzw. zagnieżdżony PCR. Nowe kinazy zostały wtedy nazwane Just Another Kinase. Do rodziny kinaz JAK należą również JAK3 oraz TYK2 (Tyrosine Kinase 2). Kinazy JAK są białkami wielodomenowymi o ciężarze cząsteczkowym wynoszącym około 120-140 kDa. Ich budowę ilustruje Schemat 1. Sekwencja białek JAK została podzielona na siedem regionów homologii JH1-7 (JAK Homology) z początkiem na C-końcu białek JAK (Wilks 1991). Domena katalityczna (JH1, o ciężarze cząsteczkowym około 40 kDa) znajduje się na C-końcu białka i jest funkcjonalną kinazą tyrozynową. Z domeną JH1 sąsiaduje tzw. domena pseudokinazowa JH2. Funkcja domeny JH2 polega na negatywnej regulacji aktywności katalitycznej domeny kinazowej. To właśnie te dwie sąsiadujęce ze sobą domeny zaispirowały nazwę kinaz JAK - kinazy Janusa. W starożytnej rzymskiej mitologii Janus był bożkiem o dwóch twarzach strzegącym początków i przejść, wrót i drzwi. W części N-końcowej białek JAK zostały zidentyfikowane jeszcze dwie domeny: trzecia FERM oraz czwarta SH2. Rola tych domen polega przede wszystkim na asocjacji i kotwiczeniu całego białka do cytoplazmatycznej cześci receptorów cytokin, czynników wzrostu oraz hormonów.
| kinaza JAK | para tyrozyn |
|---|---|
| JAK1 | Tyr1038/Tyr1039 |
| JAK2 | Tyr1007/Tyr1008 |
| JAK3 | Tyr980/Tyr981 |
| TYK2 | Tyr1054/Tyr1055 |
Ważną częścią struktury kinaz JAK jest pętla aktywacyjna, w której zlokalizowane są chrakterystyczne dla kinaz JAK ewolucyjnie konserwowane pary tyrozyn (przedstawione w Tabeli 1). Mechanizm aktywacji kinaz JAK opiera się na autofosforylacji tych reszt tyrozyny. Dołączenie rszt fosforanów powoduje otwarcie pętli aktywacyjnej i przesunięcie motywu DFG do konformacji aktywnej DFG-in, zdolnego do wiązania kationów magnezu. Autofosforylacja umożliwia również wiązanie wielu białek regulatorowych, np.: SOCS, PTP. Charakterystyczna dla kinaz JAK jest również tzw. pętla insercyjna również zaangażowana w regulację aktywności fosforylacyjnej tych kinaz (Lucet 2006).