| Linia 3: | Linia 3: | ||
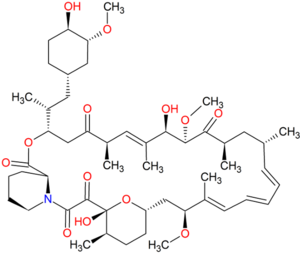
'''Rapamycyna''', znana również jako '''sirolimus''', jest naturalnym laktonem makrocyklicznym, wyizolowanym z gleby na wyspie Wielkanocnej w latach 70-tych ubiegłego stulecia jako związek o aktywności przeciwgrzybiczej.{{r|Vezina et al. 1975}} Syntetyzowany jest przez mikroorganizm o nazwie ''Streptomyces'' ''hygroscopicus''. Rapamycyna jest inhibitorem kinazy [[mTOR]] (<u>m</u>echanistic <u>t</u>arget <u>o</u>f <u>r</u>apamycin).{{r|Heitman et al. 1991}}{{r|Zheng et al. 1995}} do najważniejszych właściwości biologicznych tego inhibitora należą: | '''Rapamycyna''', znana również jako '''sirolimus''', jest naturalnym laktonem makrocyklicznym, wyizolowanym z gleby na wyspie Wielkanocnej w latach 70-tych ubiegłego stulecia jako związek o aktywności przeciwgrzybiczej.{{r|Vezina et al. 1975}} Syntetyzowany jest przez mikroorganizm o nazwie ''Streptomyces'' ''hygroscopicus''. Rapamycyna jest inhibitorem kinazy [[mTOR]] (<u>m</u>echanistic <u>t</u>arget <u>o</u>f <u>r</u>apamycin).{{r|Heitman et al. 1991}}{{r|Zheng et al. 1995}} do najważniejszych właściwości biologicznych tego inhibitora należą: | ||
* przeciwnowotworowe, hamowanie proliferacji i wzrostu komórek eukariotycznych (własności ), | * przeciwnowotworowe, hamowanie proliferacji i wzrostu komórek eukariotycznych (własności ), | ||
| − | * immunosupresyjne poprzez hamowanie aktywacji i proliferacji limfocytów T | + | * immunosupresyjne poprzez hamowanie aktywacji i proliferacji limfocytów T oraz B, |
* hamowanie produkcji przeciwciał, | * hamowanie produkcji przeciwciał, | ||
* przeciwgrzybicze, | * przeciwgrzybicze, | ||
| Linia 20: | Linia 20: | ||
Rapamycyna tworzy kompleks z białkiem FKBP12 (<u>FK</u>506-<u>b</u>inding <u>p</u>rotein 12) oraz domeną FRB (<u>F</u>KBP12–<u>r</u>apamycin <u>b</u>inding) kinazy [[mTOR]].{{r|Brown et al. 1994}}{{r|Sabatini et al. 1994}}{{r|Sabers et al. 1995}} Białka te oddziałują głównie z cząsteczką rapamycyny, natomiast bezpośrednie oddziaływanie FKBP12-mTOR ma minimalny wpływ na tworzenie kompleksu. Antybiotyk ten umożliwia zatem dimeryzację białka FKBP12 oraz domeny FRB. Kompleks rapamycyna–FKBP12 jest allosterycznym inhibitorem '''TORC1'''. Mechanizm inhibicji może być przynajmniej częściowo wyjaśniony poprzez blokowanie dostępu substratów do centrum aktywnego kinazy mTOR.{{r|Choi et al. 1996}}{{r|Liang et al. 1999}}{{r|Choo and Blenis 2009}}{{r|Yang et al. 2013}} Odległość pomiędzy FKBP12 oraz mLST8 może zmniejszać się zaledwie do 8 Å, zamykając i tak wąską szczelinę prowadzącą do centrum aktywnego kinazy mTOR. Rapamycyna hamuje TORC1 w różnym stopniu w zależności od substratów reakcji fosforylacji (np. S6K1 ''vs.'' 4E-BP1), a także fosforylowanych aminokwasów. | Rapamycyna tworzy kompleks z białkiem FKBP12 (<u>FK</u>506-<u>b</u>inding <u>p</u>rotein 12) oraz domeną FRB (<u>F</u>KBP12–<u>r</u>apamycin <u>b</u>inding) kinazy [[mTOR]].{{r|Brown et al. 1994}}{{r|Sabatini et al. 1994}}{{r|Sabers et al. 1995}} Białka te oddziałują głównie z cząsteczką rapamycyny, natomiast bezpośrednie oddziaływanie FKBP12-mTOR ma minimalny wpływ na tworzenie kompleksu. Antybiotyk ten umożliwia zatem dimeryzację białka FKBP12 oraz domeny FRB. Kompleks rapamycyna–FKBP12 jest allosterycznym inhibitorem '''TORC1'''. Mechanizm inhibicji może być przynajmniej częściowo wyjaśniony poprzez blokowanie dostępu substratów do centrum aktywnego kinazy mTOR.{{r|Choi et al. 1996}}{{r|Liang et al. 1999}}{{r|Choo and Blenis 2009}}{{r|Yang et al. 2013}} Odległość pomiędzy FKBP12 oraz mLST8 może zmniejszać się zaledwie do 8 Å, zamykając i tak wąską szczelinę prowadzącą do centrum aktywnego kinazy mTOR. Rapamycyna hamuje TORC1 w różnym stopniu w zależności od substratów reakcji fosforylacji (np. S6K1 ''vs.'' 4E-BP1), a także fosforylowanych aminokwasów. | ||
| − | Analogi chemiczne rapamycyny nazywane są '''rapalogami'''. Obecnie rapalogi znajdują się w fazie testów klinicznych jako potencjalne leki przeciwko chorobom nowotworowym, autoimmunologicznym (jak np. reumatoidalne zapalenie stawów), a także w transplantologii czy też leczeniu restenozy wieńcowej. | + | Analogi chemiczne rapamycyny nazywane są '''rapalogami'''. Obecnie rapalogi znajdują się w fazie testów klinicznych jako potencjalne leki przeciwko chorobom nowotworowym, autoimmunologicznym (jak np. reumatoidalne zapalenie stawów), a także w transplantologii czy też leczeniu restenozy wieńcowej. |
| + | <!-- | ||
| + | In 2012 National Cancer Institute listed more than 200 clinical trials testing the anticancer activity of rapalogs both as monotherapy or as a part of combination therapy for many cancer types | ||
| + | Animal and clinical studies show that rapalogs are primarily cytostatic, and therefore effective as disease stabilizers rather than for regression.[20] The response rate in solid tumors where rapalogs have been used as a single-agent therapy have been modest. Due to partial mTOR inhibition as mentioned before, rapalogs are not sufficient for achieving a broad and robust anticancer effect, at least when used as monotherapy | ||
| + | |||
| + | These limitations have led to the development of the second generation of mTOR inhibitors | ||
| + | --> | ||
{|class="wikitable" style="text-align:center; margin: auto auto auto auto" border="1" | {|class="wikitable" style="text-align:center; margin: auto auto auto auto" border="1" | ||
| Linia 31: | Linia 37: | ||
|- | |- | ||
|rapamycyna (sirolimus) | |rapamycyna (sirolimus) | ||
| + | |miesak Kaposiego, chłoniaki, nowotwory związane ze stwardnieniem guzowatym (np.: podwyściółkowy gwiaździak olbrzymiokomórkowy, naczyniakomięśniakotłuszczak), toczeń rumieniowaty układowy, autosomalna dominująca wielotorbielowatość nerek | ||
| + | |<span title="ulotka producenta leku">[http://www.accessdata.fda.gov/drugsatfda_docs/nda/2000/21110_Rapamune_prntlbl.pdf Rapamune]</span> | ||
|transplantologia nerki | |transplantologia nerki | ||
| − | |<span title=" | + | |PF PRISM CV (<span title="Food and Drug Administration">FDA</span> 1999) |
| − | |||
| − | |||
|- | |- | ||
|rapamycyna (sirolimus) | |rapamycyna (sirolimus) | ||
|transplantologia nerki | |transplantologia nerki | ||
| − | |<span title="ulotka producenta leku">[http:// | + | |<span title="ulotka producenta leku">[http://dailymed.nlm.nih.gov/dailymed/getFile.cfm?setid=ec473170-47f1-4a5c-b4d9-ac36406ed241&type=pdf&name=ec473170-47f1-4a5c-b4d9-ac36406ed241 Sirolimus]</span> |
|<nowiki>-</nowiki> | |<nowiki>-</nowiki> | ||
| − | | | + | |Zydus Pharmaceuticals (<span title="Food and Drug Administration">FDA</span> 2014) |
|- | |- | ||
| − | |temsirolimus | + | |temsirolimus (CCI-779) |
|rak nerkowokomórkowy w zaawansowanym stadium | |rak nerkowokomórkowy w zaawansowanym stadium | ||
|<span title="ulotka producenta leku">[http://www.accessdata.fda.gov/drugsatfda_docs/label/2014/022088s016lbl.pdf Torisel]</span> | |<span title="ulotka producenta leku">[http://www.accessdata.fda.gov/drugsatfda_docs/label/2014/022088s016lbl.pdf Torisel]</span> | ||
|<nowiki>-</nowiki> | |<nowiki>-</nowiki> | ||
| − | |PF PRISM CV (2007) | + | |PF PRISM CV (<span title="Food and Drug Administration">FDA</span> 2007, <span title="European Medicines Agency">EMA</span> 2007) |
|- | |- | ||
| − | |everolimus | + | |everolimus (RAD001) |
|rak żołądka, chłoniaki, rak wątrobowokomórkowy, choroba przeszczep przeciwko gospodarzowi <span title="graft-versus-host disease">GVHD</span>, zaawansowany rak pęcherza moczowego | |rak żołądka, chłoniaki, rak wątrobowokomórkowy, choroba przeszczep przeciwko gospodarzowi <span title="graft-versus-host disease">GVHD</span>, zaawansowany rak pęcherza moczowego | ||
|<span title="ulotka producenta leku">[Zortress (USA)<br>Certican (Europa)<br>Afinitor(onkologia)]</span> | |<span title="ulotka producenta leku">[Zortress (USA)<br>Certican (Europa)<br>Afinitor(onkologia)]</span> | ||
|transplantologia nerki, wątroby, serca <br> rak nerkowokomórkowy w zaawansowanym stadium <br> nieoperacyjny podwyściółkowy gwiaździak olbrzymiokomórkowy związany ze stwardnieniem guzowatym <br> nieoperacyjne postępujące guzy neuroendokrynne trzustki <br> postmenopauzalny nowotwór piersi (hormon-receptor pozytywny i HER2-negatywny) (w sprzężeniu z eksemestanem) <br> restenoza (używany w stentach <span title="drug-eluting stent">DES</span>) | |transplantologia nerki, wątroby, serca <br> rak nerkowokomórkowy w zaawansowanym stadium <br> nieoperacyjny podwyściółkowy gwiaździak olbrzymiokomórkowy związany ze stwardnieniem guzowatym <br> nieoperacyjne postępujące guzy neuroendokrynne trzustki <br> postmenopauzalny nowotwór piersi (hormon-receptor pozytywny i HER2-negatywny) (w sprzężeniu z eksemestanem) <br> restenoza (używany w stentach <span title="drug-eluting stent">DES</span>) | ||
| − | |Novartis(2009) | + | |Novartis(<span title="Food and Drug Administration">FDA</span> 2009, <span title="European Medicines Agency">EMA</span> 2009) |
|- | |- | ||
|everolimus | |everolimus | ||
| Linia 60: | Linia 66: | ||
|Biocon() | |Biocon() | ||
|- | |- | ||
| + | |ridaforolimus (deforolimus, AP-23573) | ||
| + | |metastatyczne mięsaki tkanek miękkich i kości | ||
| + | |<span title=""></span> | ||
| | | | ||
| + | |Merck oraz ARIAD Pharmaceuticals | ||
| + | |- | ||
| + | |ridaforolimus | ||
| + | | | ||
| + | |<span title="ulotka producenta leku">[]</span> | ||
| + | |() | ||
| + | |- | ||
| + | |ridaforolimus | ||
| | | | ||
|<span title="ulotka producenta leku">[]</span> | |<span title="ulotka producenta leku">[]</span> | ||
| Linia 66: | Linia 83: | ||
|} | |} | ||
| − | Najważniejsze skutki uboczne stosowania | + | |
| + | Najważniejsze skutki uboczne stosowania rapamycyny to: | ||
* podwyższone ryzyko nowotworów, głównie chłoniaków oraz nowotworów skóry | * podwyższone ryzyko nowotworów, głównie chłoniaków oraz nowotworów skóry | ||
| − | * podwyższone ryzyko infekcji, w tym zagrażających życiu pacjenta. | + | * podwyższone ryzyko infekcji, w tym zagrażających życiu pacjenta, |
| + | * choroby śródmiąższowe płuc, | ||
| + | * symptomy cukrzycopodobne. | ||
Są one konsekwencją osłabienia działania układu immunologicznego przez rapamycynę oraz jej analogi. Nie zaleca się podawania leku u chorych po przeszczepie płuc lub wątroby. | Są one konsekwencją osłabienia działania układu immunologicznego przez rapamycynę oraz jej analogi. Nie zaleca się podawania leku u chorych po przeszczepie płuc lub wątroby. | ||
Wersja z 13:00, 10 cze 2014
Rapamycyna, znana również jako sirolimus, jest naturalnym laktonem makrocyklicznym, wyizolowanym z gleby na wyspie Wielkanocnej w latach 70-tych ubiegłego stulecia jako związek o aktywności przeciwgrzybiczej.[1] Syntetyzowany jest przez mikroorganizm o nazwie Streptomyces hygroscopicus. Rapamycyna jest inhibitorem kinazy mTOR (mechanistic target of rapamycin).[2][3] do najważniejszych właściwości biologicznych tego inhibitora należą:
- przeciwnowotworowe, hamowanie proliferacji i wzrostu komórek eukariotycznych (własności ),
- immunosupresyjne poprzez hamowanie aktywacji i proliferacji limfocytów T oraz B,
- hamowanie produkcji przeciwciał,
- przeciwgrzybicze,
- hamowanie produkcji cytokin poprzez selektywne blokowanie aktywacji transkrypcyjnej ich genów
Właściwości bioaktywne rapamycyne są zalezne od wiązania tego antybiotyku przez immunofiliny.
Rapamycyna tworzy kompleks z białkiem FKBP12 (FK506-binding protein 12) oraz domeną FRB (FKBP12–rapamycin binding) kinazy mTOR.[4][5][6] Białka te oddziałują głównie z cząsteczką rapamycyny, natomiast bezpośrednie oddziaływanie FKBP12-mTOR ma minimalny wpływ na tworzenie kompleksu. Antybiotyk ten umożliwia zatem dimeryzację białka FKBP12 oraz domeny FRB. Kompleks rapamycyna–FKBP12 jest allosterycznym inhibitorem TORC1. Mechanizm inhibicji może być przynajmniej częściowo wyjaśniony poprzez blokowanie dostępu substratów do centrum aktywnego kinazy mTOR.[7][8][9][10] Odległość pomiędzy FKBP12 oraz mLST8 może zmniejszać się zaledwie do 8 Å, zamykając i tak wąską szczelinę prowadzącą do centrum aktywnego kinazy mTOR. Rapamycyna hamuje TORC1 w różnym stopniu w zależności od substratów reakcji fosforylacji (np. S6K1 vs. 4E-BP1), a także fosforylowanych aminokwasów.
Analogi chemiczne rapamycyny nazywane są rapalogami. Obecnie rapalogi znajdują się w fazie testów klinicznych jako potencjalne leki przeciwko chorobom nowotworowym, autoimmunologicznym (jak np. reumatoidalne zapalenie stawów), a także w transplantologii czy też leczeniu restenozy wieńcowej.
| rapalog | wskazanie terapeutyczne | nazwa leku | badania kliniczne | firma (rok zatwierdzenia) |
|---|---|---|---|---|
| rapamycyna (sirolimus) | miesak Kaposiego, chłoniaki, nowotwory związane ze stwardnieniem guzowatym (np.: podwyściółkowy gwiaździak olbrzymiokomórkowy, naczyniakomięśniakotłuszczak), toczeń rumieniowaty układowy, autosomalna dominująca wielotorbielowatość nerek | Rapamune | transplantologia nerki | PF PRISM CV (FDA 1999) |
| rapamycyna (sirolimus) | transplantologia nerki | Sirolimus | - | Zydus Pharmaceuticals (FDA 2014) |
| temsirolimus (CCI-779) | rak nerkowokomórkowy w zaawansowanym stadium | Torisel | - | PF PRISM CV (FDA 2007, EMA 2007) |
| everolimus (RAD001) | rak żołądka, chłoniaki, rak wątrobowokomórkowy, choroba przeszczep przeciwko gospodarzowi GVHD, zaawansowany rak pęcherza moczowego | [Zortress (USA) Certican (Europa) Afinitor(onkologia)] |
transplantologia nerki, wątroby, serca rak nerkowokomórkowy w zaawansowanym stadium nieoperacyjny podwyściółkowy gwiaździak olbrzymiokomórkowy związany ze stwardnieniem guzowatym nieoperacyjne postępujące guzy neuroendokrynne trzustki postmenopauzalny nowotwór piersi (hormon-receptor pozytywny i HER2-negatywny) (w sprzężeniu z eksemestanem) restenoza (używany w stentach DES) |
Novartis(FDA 2009, EMA 2009) |
| everolimus | [Evertor] | Biocon() | ||
| ridaforolimus (deforolimus, AP-23573) | metastatyczne mięsaki tkanek miękkich i kości | Merck oraz ARIAD Pharmaceuticals | ||
| ridaforolimus | [] | () | ||
| ridaforolimus | [] | () |
Najważniejsze skutki uboczne stosowania rapamycyny to:
- podwyższone ryzyko nowotworów, głównie chłoniaków oraz nowotworów skóry
- podwyższone ryzyko infekcji, w tym zagrażających życiu pacjenta,
- choroby śródmiąższowe płuc,
- symptomy cukrzycopodobne.
Są one konsekwencją osłabienia działania układu immunologicznego przez rapamycynę oraz jej analogi. Nie zaleca się podawania leku u chorych po przeszczepie płuc lub wątroby.
Literatura
- ↑ Vézina C, Kudelski A, Sehgal SN. Rapamycin (AY-22,989), a new antifungal antibiotic. I. Taxonomy of the producing streptomycete and isolation of the active principle. The Journal of Antibiotics. 1975;28(10):721-6.
- ↑ Heitman J, Movva NR, Hall MN. Targets for cell cycle arrest by the immunosuppressant rapamycin in yeast. Science. 1991;253(5022):905–9.
- ↑ Zheng XF, Florentino D, Chen J, Crabtree GR, Schreiber SL. TOR kinase domains are required for two distinct functions, only one of which is inhibited by rapamycin. Cell. 1995;82:121-130.
- ↑ Brown EJ, Albers MW, Shin TB, Ichikawa K, Keith CT, Lane WS, Schreiber SL. A mammalian protein targeted by G1-arresting rapamycin-receptor complex. Nature. 1994;369(6483):756-8.
- ↑ Sabatini DM, Erdjument-Bromage H, Lui M, Tempst P, Snyder SH. RAFT1: a mammalian protein that binds to FKBP12 in a rapamycin-dependent fashion and is homologous to yeast TORs. Cell. 1994;78(1):35-43.
- ↑ Sabers CJ, Martin MM, Brunn GJ, Williams JM, Dumont FJ, Wiederrecht G, Abraham RT. Isolation of a protein target of the FKBP12-rapamycin complex in mammalian cells. The Journal of Biological Chemistry. 1995;270(2):815-22.
- ↑ Choi J, Chen J, Schreiber SL, Clardy J. Structure of the FKBP12-rapamycin complex interacting with the binding domain of human FRAP. Science. 1996;273(5272):239-42.
- ↑ Liang J, Choi J, Clardy J. Refined structure of the FKBP12-rapamycin-FRB ternary complex at 2.2 A resolution. Acta Crystallographica. Section D, Biological Crystallography. 1999;55(Pt 4):736-44.
- ↑ Choo AY, Blenis J. Not all substrates are treated equally: implications for mTOR, rapamycin-resistance and cancer therapy. Cell Cycle. 2009;8(4):567-72.
- ↑ Yang H, Rudge DG, Koos JD, Vaidialingam B, Yang HJ, Pavletich NP. mTOR kinase structure, mechanism and regulation. Nature. 2013;497(7448):217-23.