Białka MMP
Grupa białek enzymatycznych – macierzowych metaloproteinaz, w skład której wchodzi 21 enzymów podzielonych na podgrupy w zależności od struktury czwartorzędowej i specyficzności substratowej. Listę obecnie zidentyfikowanych MMP przedstawia Tabela 1.
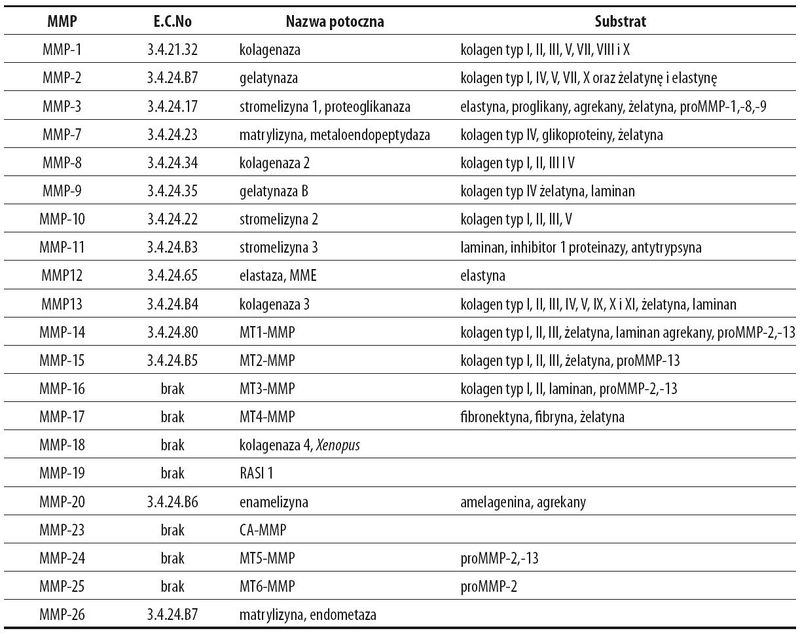
Wszystkie MMP zawierają w swojej strukturze propeptyd i wchodzący w jego strukturę peptyd sygnałowy kierujący je do miejsc docelowych oraz domenę katalityczną.
Grupy białek MMP:
- Metrylizyny: nie posiadają w swojej strukturze domeny hemopeksyny. Określane także mianem endometaloproteinaz (MMP-1, MMP-7). Substratami dla działania metrylizyn są makrocząsteczki macierzy pozakomórkowej ECM, oraz obecne na powierzchni komórek FasL, pro-TNF, E-kadheryna, przez co uczestniczą w apoptozie komórki.
- Kolagenazy: czyli MMP-1, -8, -13. Zawierają w swojej strukturze domenę hemopeksyny oraz tzw. giętki łącznik spajający ją z domeną katalityczną. Substratami ich działania są kolageny typu I, II, III, V oraz IX.
- Stromelizyny: MMP-3, MMP-10. Oba enzymy mają podobną swoistość substratową ale odmienną efektywność proteolityczną na korzyść MMP-3. Hydrolizują komponenty ECM. Ponadto MMP-3 aktywuje liczne zymogeny (proMMP), a jej obecność jest konieczna do aktywacji MMP-1.
- Gelatynazy: MMP-2 i MMP-9. Zawierają w domenie katalitycznej motywu złożonego z trzech modułów typu II fibronektyny. Mają duże powinowactwo substratowe względem żelatyny oraz denaturowanego kolagenu. Ponadto MMP-2 hydrolizuje wiązania peptydowe w I, II oraz III typie kolagenu.
- Błonowe MMP: 6 enzymów podzielonych na dwie grupy. Do pierwszej grupy należą makrocząsteczki białek błonowych: MMP-14, -15, -16, -24. Grupa druga to MMP-17 oraz MMP-25, które są połączone z glikofosfatydyloinozytolem. MMP tej grupy poza MMP-17, biorą udział w procesach aktywacji proMMP-2. Substratami tych enzymów są komponenty ECM.
- Pozostałe MMP: grupa siedmiu enzymów MMP, które nie zostały przyporządkowane do żadnej z powyższych grup. Metaloelastaza występuje głównie w makrofagach i odpowiada za zdolność do migracji. MMP-19 występuje w naczyniach krwionośnych błony maziowej stawów. Enemelizyna, czyli MMP-20 hydrolizuje amelogeninę szkliwa a jego brak skutkuje zaburzeniami jego rozwoju. MMP-23 występuje głównie w tkankach rozrodczych. Nie posiada przyłącznika cysternowego w prodomenie, nie posiada domeny hemopeksyny oraz bogatej w cysteinę domeny położonej tuż za motywem immunoglobulinopodobnym. MMP-28 występuje głównie w keratynocytach. Bierze udział w procesie hemostazy oraz gojeniu ran.
Budowa białek MMP:
- Domena katalityczna: odpowiada za aktywność enzymatyczną MMP. W domenie znajduje się jeden katalityczny i jeden strukturalny jon cynku oraz trzy jony wapniowe.
- Prodomena: zawiera propeptyd utrzymujący enzym w postaci nieaktywnej
- Domena hemopeksyny: zawdzięcza swoją nazwę analogii sekwencji do hemopeksyny (białka wiążącego i przenoszącego hem). Tylko MMP-7, MMP-23 i MMP-26 nie zawierają tej domeny. Z kolei w MMP-12 traci domenę hemopeksyny po aktywacji, jednakże nie wpływa to na jej aktywność. Natomiast w przypadku kolagenaz domena ta jest konieczna aby mógł zaistnieć proces trawienia superhelisy kolagenowej. Inną ważną funkcją tej domeny jest zdolność wiązania tkankowego inhibitora metaloproteinaz TIMP przez MMP-9. Z kolei w niektórych MMP w domenie hemopeksyny wykryto jony wapnia, sodu, chloru w centrum aktywnym, co wskazuje na możliwy udział w reakcji enzymatycznej.
- Elastyczny łącznik: fragment łączący domenę katalityczną oraz domenę hemopeksyny składający się z 15-65 aminokwasów. Jest istotnym elementem utrzymującym stabilną strukturę cząsteczki oraz ma istotne znaczenie w degradacji niektórych substratów MMP jak kolagen.
Mechanizm aktywacji pro-MMP
Aktywacja MMP odbywa się poprzez usunięcie prodomeny co odsłania miejsce aktywne enzymu. MMP mogą być aktywowane przez inne proteazy, czynniki chemiczne, utleniony glutation, SDS, niskie pH, podwyższoną temperaturę. Większość MMP aktywowana jest na powierzchni komórki. Tylko nieliczne MMP ulegają aktywacji wewnątrzkomórkowo w aparacie Golgiego.
Piśmiennictwo: